药品专利纠纷早期解决机制行政裁决已公开案件概述
2023-11-24文/北京市集佳律师事务所 尹玉峰
药品专利纠纷早期解决机制或者药品专利链接制度是将药品上市审批程序与药品专利纠纷解决程序相衔接的制度。2021年6月1日实施的《中华人民共和国专利法》(以下简称《专利法》)的第七十六条规定:药品上市审评审批过程中,药品上市许可申请人与有关专利权人或者利害关系人,因申请注册的药品相关的专利权产生纠纷的,相关当事人可以向人民法院起诉,请求就申请注册的药品相关技术方案是否落入他人药品专利权保护范围作出判决。国务院药品监督管理部门在规定的期限内,可以根据人民法院生效裁判作出是否暂停批准相关药品上市的决定。
药品上市许可申请人与有关专利权人或者利害关系人也可以就申请注册的药品相关的专利权纠纷,向国务院专利行政部门请求行政裁决。
国务院药品监督管理部门会同国务院专利行政部门制定药品上市许可审批与药品上市许可申请阶段专利权纠纷解决的具体衔接办法,报国务院同意后实施。
以上规定了药品专利纠纷早期解决机制(药品专利链接制度),也是《专利法》第四次修改中的重要内容。
药品专利纠纷早期解决机制的目的就在于,在药品上市审评审批阶段提前解决仿制药获批后进入生产经营可能导致的专利纠纷,在保护原研药专利权的同时,鼓励仿制药发展,提高药品可及性【1】。如《专利法》第七十六条的规定,行政裁决是其中的一个重要途径。国家知识产权局相应地制定了《药品专利纠纷早期解决机制行政裁决办法》(以下简称《行政裁决办法》)并于2021年7月5日实施。
截止2023年8月30日,国家知识产权局网站共公开了76件行政裁决案件的相关信息,包括行政裁决书和行政裁决结案通知书。在公开的裁决书中,并没有具体的裁决过程以及所依据的事实,从其中可以获得以下信息:案件编号,专利信息,仿制药申请受理信息,药品名称、剂型、规格,请求人及委托代理人,被请求人及委托代理人,行政裁决结论,行政裁决的请求日,行政裁决的作出日以及裁决要点等。
基于上述公开的信息,本文对于已经公开的案件进行了整理和简要分析。
一、行政裁决案件所涉及的药品
76件公开的案件共涉及21种药品,这些药品的基本信息如下:
|
序号 |
药品 |
规格 |
所涉及的专利 |
|
1 |
甲苯磺酸艾多沙班片 |
15 mg、30 mg、60 mg |
ZL201410468293.6 |
|
2 |
乙磺酸尼达尼布软胶囊 |
100 mg、150 mg |
ZL200580044703.3 |
|
3 |
注射用卡非佐米 |
10 mg、30 mg、60 mg |
ZL200580033600.7 |
|
4 |
盐酸羟考酮缓释片 |
10 mg |
ZL201210135209.X ZL201510599477.0 ZL201010151552.4 |
|
5 |
尼洛替尼胶囊 |
150 mg、200 mg |
ZL200680026444.6 ZL201080051819.0 |
|
6 |
瑞戈非尼片 |
40 mg |
ZL200480021091.1 |
|
7 |
托珠单抗注射液 |
80mg/4ml、200mg/10ml、 400mg/200ml |
ZL200480011401.1 ZL201511004468.9 |
|
8 |
西格列汀二甲双胍片 |
磷酸西格列汀50mg/盐酸二甲双胍500mg 磷酸西格列汀50mg/盐酸二甲双胍850mg |
ZL200680047103.7 |
|
9 |
达格列净片 |
5 mg、10 mg |
ZL200880016902.7 ZL201210201489.X |
|
10 |
米拉贝隆缓释片 |
50 mg |
ZL200380102889.4 |
|
11 |
孟鲁司特钠颗粒 |
0.5g:4mg |
ZL02821212.6 |
|
12 |
马来酸奈拉替尼片 |
40 mg |
ZL201410082103.7 ZL200880118789.3 ZL201080060546.6 |
|
13 |
注射用达托霉素 |
500 mg |
ZL201080062122.3 |
|
14 |
甲磺酸雷沙吉兰片 |
0.5 mg、1 mg |
ZL200680005518.8 |
|
15 |
环孢素滴眼液 |
0.3ml:0.3 mg (0.1%) |
ZL200580038329.6 ZL200780033784.6 |
|
16 |
盐酸芬戈莫德胶囊 |
0.5 mg |
ZL201010121300.7 ZL200480009237.0 |
|
17 |
格列齐特缓释片 |
60 mg |
ZL200810213769.6 |
|
18 |
磷酸芦可替尼片 |
5 mg、15 mg、20 mg |
ZL200880102903.3 ZL201310059187.8 |
|
19 |
碳酸司维拉姆片 |
0.8 mg |
ZL200580036180.8 |
|
20 |
奥拉帕利片 |
100 mg、150 mg |
ZL200980150172.4 |
|
21 |
马昔腾坦片 |
10 mg |
ZL200680033375.1 |
根据《中华人民共和国药品管理法》第二条,药品包括中药、化学药和生物制品等。在上述21种药品中,仅有1种是生物制品(托珠单抗),剩余的20种均为化学药。
各种药品所涉及的行政裁决案件的数量如下所示:
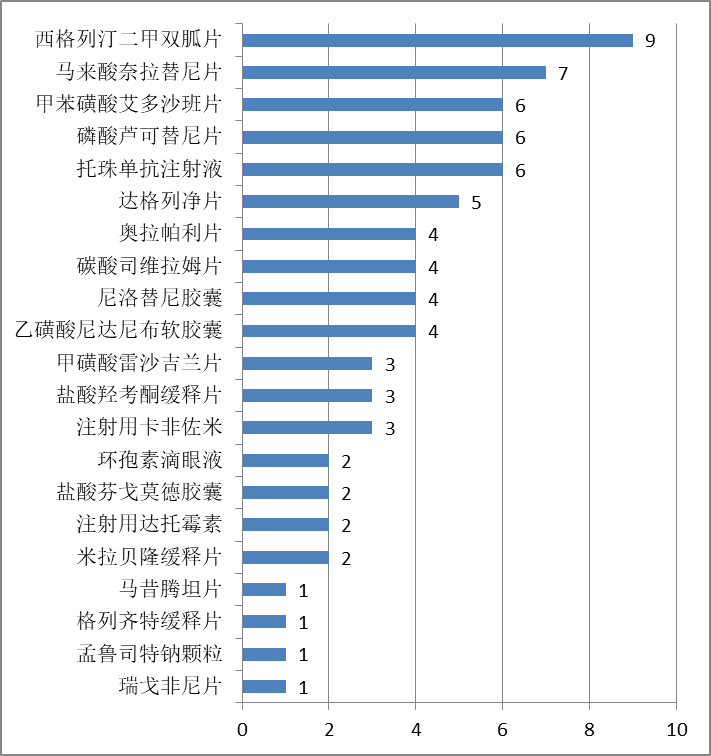
二、行政裁决的请求人
公开的76件行政裁决案件的请求人如下所示:
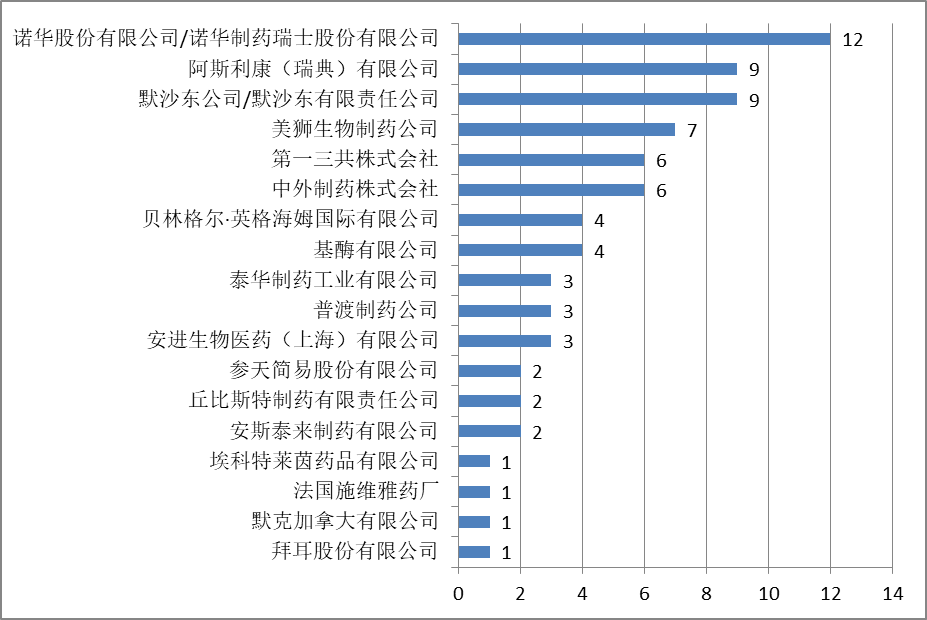
根据《行政裁决办法》第四条的规定,请求人是专利法第七十六条所称的药品上市许可申请人与有关专利权人或者利害关系人,其中的利害关系人是指相关专利的被许可人或者登记的药品上市许可持有人。
也就是说,无论是药品上市许可申请人,还是专利权人或者专利的被许可人或药品上市许可持有人,均可以请求行政裁决。然而,从已经公开的行政裁决可以看出,没有药品上市许可申请人提起行政裁决。这可能是由于行政裁决并不是终局性的,如果药品上市许可申请人提出行政裁决,可能还会引起后面的诉讼,从而使得药品技术方案是否落入专利权保护范围这一结果的确定需要更长的时间,不利于药品上市。
三、已公开的行政裁决案件的结果
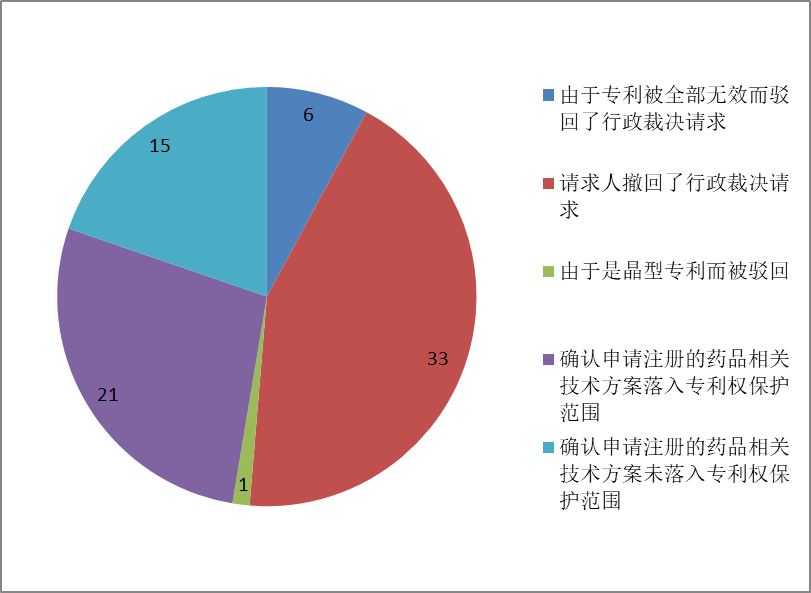
下图示出了已公开的76件行政裁决案件的结果:
(一)、驳回行政裁决请求
1、因专利被全部无效而驳回
根据《行政裁决办法》第十四条的规定,药品专利纠纷行政裁决案件办理中,涉案专利所涉及的部分权利要求被国家知识产权局宣告无效的,根据维持有效的权利要求为基础作出行政裁决;涉案专利所涉及的权利要求被国家知识产权局全部宣告无效的,驳回行政裁决请求。
在76件公开的案件中,有6件由于专利被全部无效而驳回了行政裁决请求。
|
请求人 |
被请求人 |
所涉及药品 |
所涉及专利 |
案号 |
|
诺华股份有限公司 |
苏州特瑞药业有限公司 |
尼洛替尼胶囊 |
200680026444.6 |
(2021)国知药裁0030号 |
|
诺华股份有限公司 |
苏州特瑞药业有限公司 |
尼洛替尼胶囊 |
200680026444.6 |
(2021)国知药裁0034号 |
|
安斯泰来制药有限公司 |
齐鲁制药有限公司 |
米拉贝隆缓释片 |
200380102889.4 |
(2022)国知药裁0006号 |
|
安斯泰来制药有限公司 |
石药集团中诺药业(石家庄)有限公司 |
米拉贝隆缓释片 |
200380102889.4 |
(2022)国知药裁0013号 |
|
参天简易股份有限公司 |
广东众生药业股份有限公司 |
环孢素滴眼液 |
200780033784.6 |
(2022)国知药裁0030号 |
|
法国施维雅药厂 |
海思科制药(眉山)有限公司 |
格列齐特缓释片 |
200810213769.6 |
(2022)国知药裁0034号 |
值得注意的是,根据《行政裁决办法》,如果专利被部分无效的话,那么可以基于被维持有效的权利要求继续审理并作出行政裁决。
2、因登记错误而被驳回
在76件公开的案件中,有1件由于被认定为是晶型专利((2022)国知药裁0015号,涉案药品:马来酸奈拉替尼片,专利号:200880118789.3),因此该行政裁决请求被认为不符合《行政裁决办法》规定的受理条件而被驳回。
另外还有3个裁决((2021)国知药裁0009-0011号,涉案药品:甲苯磺酸艾多沙班片)中明确提到可以登记的专利不包括晶型专利,其中还提到“如果权利要求的主题不涉及晶型,权利要求亦未采用结晶等术语或者晶型特有的表征方式(如X射线粉末衍射特征峰等)限定其为晶型,则不应将所述权利要求扩大化地理解为‘晶型专利’”。
根据《行政裁决办法》第4条的规定,当事人请求国家知识产权局对药品专利纠纷进行行政裁决的,应当符合下列条件:相关专利信息已登记在中国上市药品专利信息登记平台上,且符合《药品专利纠纷早期解决机制实施办法》的相关规定。
根据《药品专利纠纷早期解决机制实施办法(试行)》(以下简称《实施办法》)第五条和第十二条的规定以及相关的政策解读,可以在中国上市药品专利信息登记平台中登记的具体药品专利包括:化学药品(不含原料药)的药物活性成分化合物专利、含活性成分的药物组合物专利、医药用途专利;中药的中药组合物专利、中药提取物专利、医药用途专利;生物制品的活性成分的序列结构专利、医药用途专利。相关专利不包括中间体、代谢产物、晶型、制备方法、检测方法等的专利。
可见,目前只有化合物专利、含活性成分的组合物专利以及医药用途专利三项相对核心的专利被包括在药品专利纠纷早期解决机制中。
对于晶型专利是否应当被登记,有观点认为“由于同一种活性化合物存在多种晶型,而晶型专利通常只保护其中的一种或几种,且上市药品一般是保护其中的一种晶型。而仿制药企业的上市药品种中,存在晶型不同于上市药品且不落入专利保护范围的较大可能性,例如使用化合物专利中的无定形形式或者使用自行研究的其他晶型。但将晶型专利予以登记,药品上市许可申请人需要在上市申报时作出不落入专利保护范围的声明,而原研公司为成功阻碍仿制药企业药品上市,较大可能会提起诉讼或行政裁决而延缓仿制药上市的进程。而且,如果确实存在仿制药落入晶型专利的可能性,原研公司还可以通过上市后的侵权诉讼维权。故基于此,有观点主张,晶型专利不应当被列入可登记的专利类型”。【2】
在四川国为制药有限公司与阿斯利康(瑞典)有限公司确认是否落入专利权保护范围二审民事裁定((2023)最高法知民终7号【1】)中,阿斯利康公司认为涉案专利权利要求9是医药用途权利要求,从而可以登记。对此,最高院从《实施办法》第五条的文义解释、目的解释以及历史解释角度阐述了“医药用途专利”应被解释为药物活性成分化合物的医药用途专利和含活性成分的药物组合物的医药用途专利;药品专利纠纷早期解决机制目前尚处于试行阶段,应当首先解决作为药品研发和生产技术核心的发挥药理活性的药物成分相关的争议;有关行政主管机关在制定药品专利纠纷实施办法时已考虑过所谓的晶型专利,并有意将之排除在可登记专利范围之外。因此,“在已有的以分子结构表达的化合物基础上进一步以晶体晶胞参数和空间群、晶体XRPD图(数据)、固相NMR图(数据)等特征表征结晶结构的化合物专利以及包含该化合物的组合物专利不应包括在药品专利纠纷实施办法规定的药物活性成分化合物专利、含活性成分的药物组合物专利的范围内”。
然而,在实践中,晶型专利是药企对于药品进行保护所采用的常见形式,也是药品专利布局中重要的一部分。在基础化合物专利后,药企常会申请晶型专利从而延长药品保护期限。而且,晶型的不同也可能影响药品的安全性和有效性,其本身也是有意义的。
对于原研药企来说,如果允许登记晶型专利,那么将可以提前解决专利纠纷,从而实现药品专利纠纷早期解决机制的立法目的。对于仿制药企来说,如果其对于某上市药品挑战成功,甚至可以获得市场独占期,但仍然可能因为侵犯原研药企的晶型专利而无法顺利上市,这将影响仿制药企的利益。而且,仿制药企也会通过研发不同的药品晶型,从而绕开原研药厂的专利屏障。通过晶型专利的登记,仿制药企也可以比较有针对性地进行研发。对于国家知识产权局或者法院来说,也可以省去审理某个专利是否属于晶型专利,从而节约程序。
因此,建议将晶型专利纳入药品专利纠纷早期解决机制内。
(二)、行政裁决程序终止
根据《行政裁决办法》第十七条的规定,国家知识产权局作出行政裁决之前,请求人可以撤回其请求。请求人撤回其请求或者其请求视为撤回的,药品专利纠纷行政裁决程序终止。
请求人在行政裁决的结论作出后撤回其请求的,不影响行政裁决的效力。
在76件公开的案件中,其中有33件请求人撤回了行政裁决请求,相关案件汇总如下:
|
请求人 |
被请求人 |
所涉及药品 |
所涉及专利 |
所撤销请求的件数 |
|
诺华股份有限公司 |
苏州特瑞药业有限公司 |
尼洛替尼胶囊 |
201080051819.0 |
2件 |
|
中外制药株式会社 |
百奥泰生物制药股份有限公司 |
托珠单抗注射液 |
200480011401.1 |
3件 |
|
中外制药株式会社 |
百奥泰生物制药股份有限公司 |
托珠单抗注射液 |
201511004468.9 |
3件 |
|
阿斯利康(瑞典)有限公司 |
四川国为制药有限公司 |
达格列净片 |
200880016902.7 |
1件 |
|
阿斯利康(瑞典)有限公司 |
四川国为制药有限公司 |
达格列净片 |
201210201489.X |
1件 |
|
阿斯利康(瑞典)有限公司 |
北京伟林恒昌医药科技有限公司 |
达格列净片 |
201210201489.X |
2件 |
|
阿斯利康(瑞典)有限公司 |
南京方生和医药科技有限公司 |
达格列净片 |
201210201489.X |
1件 |
|
泰华制药工业有限公司 |
重庆华森制药股份有限公司 |
甲磺酸雷沙吉兰片 |
200680005518.8 |
2件 |
|
泰华制药工业有限公司 |
石家庄四药有限公司 |
甲磺酸雷沙吉兰片 |
200680005518.8 |
1件 |
|
诺华制药瑞士股份有限公司 |
北京康蒂尼药业股份有限公司 |
盐酸芬戈莫德胶囊 |
201010121300.7 |
1件 |
|
诺华制药瑞士股份有限公司 |
北京康蒂尼药业股份有限公司 |
盐酸芬戈莫德胶囊 |
200480009237.0 |
1件 |
|
丘比斯特制药有限责任公司 |
深圳立健药业有限公司 |
注射用达托霉素 |
201080062122.3 |
1件 |
|
埃科特莱茵药品有限公司 |
南京泽恒医药技术开发有限公司 |
马昔腾坦片 |
200680033375.1 |
1件 |
|
基酶有限公司 |
中美华世通生物医药科技(武汉)股份有限公司 |
碳酸司维拉姆片 |
200580036180.8 |
1件 |
|
阿斯利康(瑞典)有限公司 |
湖南科伦制药有限公司 |
奥拉帕利片 |
200980150172.4 |
2件 |
|
阿斯利康(瑞典)有限公司 |
杭州中美华东制药有限公司 |
奥拉帕利片 |
200980150172.4 |
2件 |
|
默沙东有限责任公司 |
吉林惠升生物制药有限公司 |
西格列汀二甲双胍片 |
200680047103.7 |
2件 |
|
默沙东有限责任公司 |
浙江恒研医药科技有限公司 |
西格列汀二甲双胍片 |
200680047103.7 |
2件 |
|
默沙东有限责任公司 |
济南辰欣医药科技有限公司 |
西格列汀二甲双胍片 |
200680047103.7 |
1件 |
|
默沙东有限责任公司 |
浙江九洲生物医药有限公司 |
西格列汀二甲双胍片 |
200680047103.7 |
1件 |
|
默沙东有限责任公司 |
宁波美诺华天康药业有限公司 |
西格列汀二甲双胍片 |
200680047103.7 |
2件 |
其中涉及尼洛替尼胶囊、达格列净片和西格列汀二甲双胍片的请求人均提起了确认是否落入专利权保护范围的诉讼。
(三)确认是否落入保护范围
在76件公开的案件中,有21件确认申请注册的药品相关技术方案落入专利权保护范围,而有15件确认申请注册的药品相关技术方案未落入专利权保护范围。
在上述裁决中,对于盐酸羟考酮缓释片,针对三个专利的裁定均认定申请注册的药品相关技术方案未落入专利权保护范围,请求人也提起了确认是否落入专利权保护范围的诉讼,但后续主动撤诉。对于注射用卡非佐米和瑞戈非尼片,请求人也提起了诉讼。对于这两种药品,在行政裁决中均认定申请注册的药品相关技术方案落入专利权保护范围。可能基于这样的原因,针对这两种药品的诉讼都主动撤诉了。
四、行政裁决的周期
已公开行政裁决的审理周期如下所示:
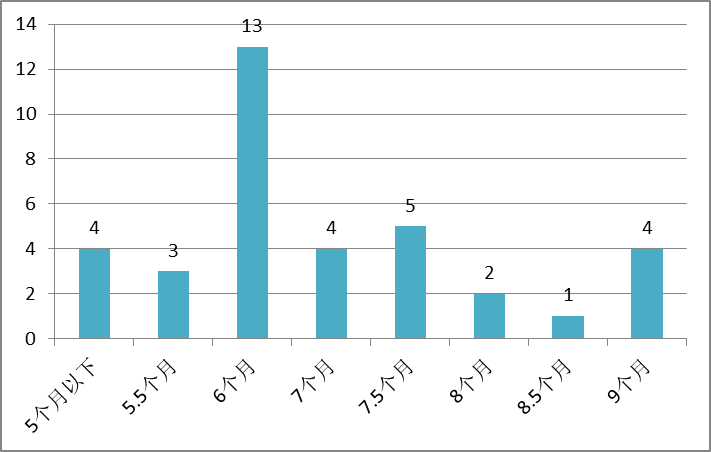
这里统计的仅是做出了确认申请注册的药品相关技术方案是否落入专利权保护范围结论的裁决,其他案件无法统计。
《实施办法》中设置了9个月的等待期。等待期自国务院专利行政部门受理之日起,只设置一次。如果超过等待期,国务院药品监督管理部门未收到国务院专利行政部门的行政裁决,按照程序将相关化学仿制药注册申请转入行政审批环节。
根据已公开的行政裁决,所有的行政裁决均是在约9个月做出的,最短的时间仅为不到4个月。
五、裁决要点
根据《行政裁决办法》第4条的规定,一项行政裁决请求应当仅限于确认一个申请上市许可的药品技术方案是否落入某一项专利权的保护范围。
可见,行政裁决的审理内容类似于侵权判定。因此,在侵权判定中涉及的全面覆盖原则、等同原则和禁止反悔原则等仍然适用。除此之外,以下列出了一些已公开裁决要点中值得关注的内容。
(一)审理范围
同一药品专利纠纷尚未被人民法院立案受理的,该行政裁决请求应予受理;同一药品专利纠纷请求人已提出药品专利纠纷行政裁决请求,并被国家知识产权局受理,该纠纷随后被人民法院立案的事实不应当成为该行政裁决请求不予受理的依据。
在行政裁决中不审理专利权无效理由,也不审理现有技术抗辩事宜。
登记专利是否覆盖原研药技术方案并非法律规定的药品专利纠纷行政裁决程序需要主动审查的内容,当仿制药申请人提出异议并举证证明登记准确性确实存疑的情况下,合议组可以对该抗辩事由予以审理。
药品专利纠纷早期解决机制行政裁决程序系解决仿制药技术方案是否落入专利权保护范围的确认之裁,虽然仿制药申请人在作出4.2类专利声明时,有义务将相应的声明依据发送权利人,仿制药申请人怠于履行《实施办法》第六条规定的信息交换义务的行为具有可责性,但在该《实施办法》和《裁决办法》均未明确规定行政裁决程序可以纠正仿制药申请人的这一行为,且信息交换义务的履行与仿制药技术方案是否落入专利权保护范围的判断也没有直接关联的情况下,责令被请求人履行信息交换义务的请求不能被纳入行政裁决的审理范围。
(二)举证责任
行政裁决主要依据仿制药申请人提交给国家药监局的申报材料。仿制药申请人负有提交仿制药技术方案的义务,未在指定期限内提交证据或者提交证据不充分的,需要承担举证不利的法律后果。然而,要求仿制药申请人无限度地提供“全部批次”的申报材料信息缺少依据,也有欠公平。
当根据仿制药申请人提交的仿制药申报材料足以判断仿制药技术方案是否落入涉案专利保护范围,尤其是足以表明仿制药技术方案未落入涉案专利保护范围时,要求调取仿制药样品进行检测,不仅混淆了早期解决机制与实体侵权之间的界限,也会因为两个程序中举证责任的不同而不恰当加重仿制药申请人的责任,导致双方利益失衡。
对于产品权利要求中的性能参数特征,如果该性能由产品的组成决定,在仿制药的组成字面落入权利要求的组成特征范围,本领域技术人员有合理理由推知仿制药高度可能具有该性能参数特征的情况下,被请求人主张仿制药不具有该性能特征或者其性能参数特征与涉案专利的相应技术特征不相同亦不等同的,应当承担相应的证明责任。
(三)判断药品技术方案是否落入权利要求保护范围时应当注意的问题
对于包含数值或数值范围的技术方案,应当严格适用等同原则;但是,如果仿制药技术方案的相应数值相较于权利要求的数值或数值范围端点虽然有区别,但仍属于相关领域公认的误差范围的,应当认为仿制药技术方案的该数值特征被权利要求所覆盖。
对于权利要求进行解释,不能随意将权利要求中未记载的技术内容解读到权利要求中。除非该权利要求实质上就是实施例所记载的技术方案,否则不能将权利要求的内容仅仅解释为说明书或附图公开的具体实施例。
在解释权利要求中技术术语的含义时,说明书及其附图可以用于解释权利要求。当说明书对于权利要求的技术术语有明确的定义时,通常应当根据该明确定义确定所述技术术语的含义;当说明书针对相同或者类似技术含义的概念采用了不同的技术术语时,通常应当将所述不同的技术术语解释为具有不同的含义。如果专利说明书对该用语无特别界定,一般应根据本领域普通技术人员理解的通常含义进行解释。
根据《实施办法》第四条第二项,医药用途专利权与获批上市药品说明书的适应症或者功能主治应当一致。将其中的“应当一致”狭义地理解为专利的医药用途与原研药的适应症“完全相同”是不恰当的。
(四)针对不同类型权利要求的考量
制药用途权利要求:对于以某一化合物的治疗机理或致病机理限定的制药用途权利要求,如果有证据表明该化合物系通过所述机理起到治疗或者预防某疾病的作用,则该化合物治疗所述疾病的技术方案落入以上制药用途权利要求的保护范围。
适应症的确定:应当以仿制药申请人在申报材料中明确要求的适应症为基础确定仿制药技术方案是否落入涉案制药用途专利的保护范围。
通式化合物:如果仿制药相关技术方案为该通式范围内的具体化合物,则应当认定仿制药相关技术方案落入涉案专利权的保护范围。
以制备方法限定的产品权利要求:所述制备方法特征对于确定专利权的保护范围具有限定作用。仿制药的制备方法与专利方法不相同也不等同的,应当认定仿制药技术方案未落入专利权的保护范围。
总的来说,行政裁决是药品专利纠纷早期解决机制中的一个重要组成部分。通常,通过行政手段处理纠纷更加快捷,并且成本更低。行政裁决并不具有终局性,如果当事人对行政裁决不服,还可以向法院起诉,甚至可以在提起行政裁决的同时,向法院起诉。专利权人或者利害关系人可能更倾向于申请行政裁决,这样可以先较快地获得一个裁决结果,然后根据情况选择是否提起诉讼,同时这也可能拖延药品的上市许可审批。与此相比,如果有必要的话,药品上市许可申请人可能会更倾向于选择提起诉讼。
在提起行政裁决申请之前,要注意所登记的专利类型是否在登记范围内,同时评估专利的稳定性以应对对方可能提起的无效请求。了解之前行政裁决中的裁决要点也可以更好地进行准备和应对审查,以期获得更有利的结果。本文对国家知识产权局网站上已公开的行政裁决进行了整理和分析,以期对于药品专利纠纷早期解决机制中行政裁决的情况有整体了解,从而有助于实际的工作。
参考文献
【1】(2023)最高法知民终7号
【2】http://www.origintelligence.com/2020/zyzs_0706/239.html




